传染病也有贫富差距吗?
传染病一直都是人们闻之色变的词语,不少小说电影,都在描述着它对人类的威胁。
虽然在全球的飞速发展下,越来越多的国家加入了药物与疫苗的研发队列,增强基础医疗建设来防治疾病,然而,仍有很多地区的人们,因为贫困,而得不到有效的预防或治疗。
从今年新型冠状肺炎的数据中我们不难得知,贫困地区所遭受的伤害,远大于发展水平中等的地区。

笼罩在疫情的阴影之下 | Aljazeera.com, Baz Ratner
贫富差距,对于传染病的防治,影响究竟有多大?而贫困地区,都面临着什么困难,我们能为他们做点什么吗?
其实在新冠疫情之外,小儿麻痹症、埃博拉病毒与疟疾,也是笼罩着贫困人民的一层阴影。以这几个为例,让我们回溯一下医学上曾经做出的努力。
小儿麻痹症与口服疫苗
其实在二十世纪,人们就已经开始利用不同的方法,对贫困地区的传染病作出针对性的防控方案。大家所熟悉的小儿麻痹症,学名叫脊髓灰质炎,是一种由微小病毒引起的急性传染病,约0.5%的被感染人群会有下肢麻痹(残疾)或上肢麻痹(无法呼吸)的症状。这些人中只有约10%可以康复,其他人则会终生残疾,或者靠着呼吸机度过。
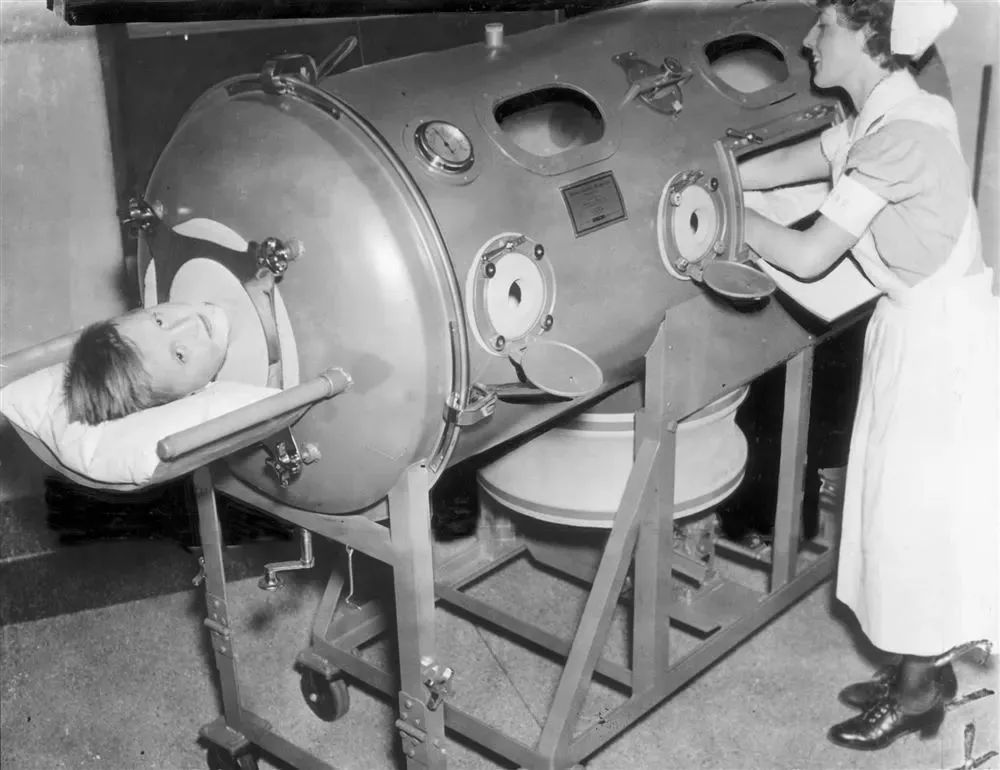
当时呼吸肌麻痹的患者,需要使用铁肺呼吸 | Post-gazette.com
面对这样可怕的疾病,用疫苗防范于未然,必定是最好的方案。1955年,乔纳斯·沙克(Jonas Salk)首次研制出通过肌肉注射的灭活疫苗,此后,小儿麻痹的发病率呈断崖式下降。
注射型的沙克疫苗,优点是非常显著的:因为使用的是灭活病毒,不存在毒性恢复,也没有被感染的危险。然而作为一款需要肌肉注射的疫苗,这意味着它的售价会更高,也需要完善的医疗体系和专业的医护人员,来完成注射。这对于贫困地区的人民来说,往往太奢侈。

研制脊灰疫苗的乔纳斯·沙克 | TIME Magazine
不过新的科技,给事情带来了新的转机。1961年,医学家阿尔伯特·沙宾(Albert Sabin)研发出了一款口服型的疫苗。这种疫苗是含有“活”病毒的。它的原理是什么呢?
简单来说,沙宾一直把病毒养在非人类(例如猴子)的细胞中,几十代过后,这些原本会感染人类的病毒,已经通过基因突变,适应了猴子的身体;当人类口服这些病毒时,它们仍可以激起很好的免疫反应,让我们产生抗体,但这些脆弱的病毒,已经无法感染我们了。

正接种口服疫苗的孩子 | Unicef.org
当然了,既然这些病毒能变异去适应猴子细胞,它们也能变异回来——这也是口服型的减毒疫苗最大的问题。约每五十万首次接种口服疫苗的人里,就会有一个人因为病毒恢复毒性而受到感染。不过,这总比不接种疫苗的结果要好太多。
沙宾研发的这种口服型疫苗,面世之后便被各国广泛使用,尤其是发展中国家。它制造成本低廉,接种方便,在低收入国家并不难推广。
更重要的是,其中的减毒病毒可以在肠道繁殖,排出体外后,还可以引起其他人身上的免疫反应,从而让没有接种的人也得到抵抗力。这也被称作群体免疫(Herd Immunity),在卫生条件较差的地区起到了至关重要的作用。

儿时好吃的糖丸也是口服型的减毒疫苗 | Chinanews.com
现如今,小儿麻痹症基本已被人类根除,只有零星感染病例存在。为了杜绝病毒突变而恢复毒性造成的感染,许多发达国家只选择接种注射型疫苗,然而,口服型疫苗为根除小儿麻痹症带来的贡献,尤其在贫困地区,是无法估量的。
埃博拉病毒与纳米测序仪
人类对抗传染病的脚步从未停歇,然而,不少严重的传染疾病仍在发生,而受多种传染病肆虐的,主要是非洲与南美的贫困地区。
城市化的进程让人们逐渐聚集起来,生活在一起,高人口密度无疑增大了传染风险,可当地的医疗与教育水平没有跟上,很大程度上限制了消灭疾病的步伐。

几内亚首都科纳克里的城市市场。城市化的进程无疑提高了人口密度 | Nature.com, Emmanuel Braun
还记得2014~2016年埃博拉病毒病的暴发吗?埃博拉(Ebola)是一种丝状病毒,只要接触了患者的体液、血液以及被其污染的物品,被感染者则会因出血不止,器官衰竭而死亡。在这一年的暴发一共有近三万病例,死亡率接近50%,而当地人却拒绝接受“传染病”这个事实——他们相信这场瘟疫是由魔鬼引起的。
当地薄弱的科学观念以及对现代医学的恐惧,让疫情走向失控,让当地损失惨重。
埃博拉病毒的可怕之处还在于,在宿主死后七天,病毒仍然具有感染性,依旧可以通过接触传染。而依据当地人的习俗,村庄里的人们,往往会前来拥抱去世的同村人以表达哀悼。这对于当地的疫情防控,无疑是雪上加霜。
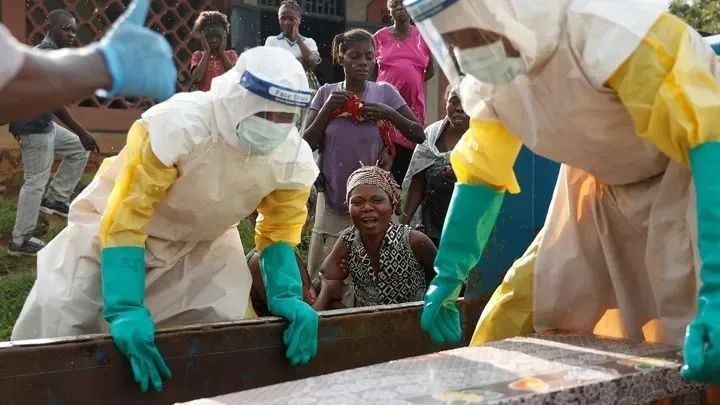
埃博拉疫情下的医护人员与当地居民 | Theatlantic.com
目前研发的埃博拉特效药,治愈效率偏低,只能说越早治疗,存活可能性越大,最重要的,还是追踪传染源——通过基因测序判断传染路径。举个例子,病毒的变异速度是恒定的,如果病人A和B体内的病毒有一样的变异点,则说明二人极有可能通过同一个途径被感染。
传统的基因测序需要巨大的仪器,然而非洲很多道路不通,很难把仪器运进来。这些仪器价格昂贵,测序需要长达一周,且要有完整的冷链、实验室的环境、有经验的科研人员。

埃博拉的测序工作,面临着多重难题 | worldpolicy.org
可埃博拉暴发在贫困的非洲,哪里去找这么多像样的实验室?更别说我们人手短缺,需要与病毒“赛跑”,这办法显然行不通。
而此时,一种新研制的纳米基因测序仪帮了大忙——虽然它只有USB大小,却可以替代以往庞大的测序机器。它采用了纳米孔新科技,能直接对提取出的RNA进行测序,读取病毒的全基因。往往24小时内就可以得到基因测序结果,并将数据结果直接输出到电脑。
美中不足的是,它的测序准确率要比传统测序稍低些;由于非洲网络不稳定,分析数据时常有卡断。这些问题也正在被逐一解决,比如多次测序以提高结果准确率、开发出线下数据分析软件等。

USB大小的纳米基因测序仪 | Directorsblog.nih.gov
这个小测序仪的出现,为对抗埃博拉病毒的防控工作带来了巨大突破。
现在,埃博拉病毒疫苗也已经通过临床实验,科学家们也将用人口密度、贫困度等数据通过计算模型,找到最适合的疫苗接种方案。
疟疾与基因驱动
肆虐于热带贫困地区的,还有一个大家有所耳闻的传染病——疟疾。
这是一种主要通过疟蚊(Anopheles)叮咬传播的寄生虫病。疟原虫会在母蚊子的肠道里进行有性生殖,而在蚊虫叮咬人类时,通过口器进入人体,进行无性繁殖。而当蚊子再次叮咬感染者时,新出生的疟原虫又进入蚊子肠道内,继续新一轮的生命周期。

传播疟疾的疟蚊 | Jhu.edu
这种寄生在蚊子肠道的疟原虫,和艾滋病毒、肺结核,并列为贫困地区造成死亡的“三巨头”。既然通过蚊虫叮咬传播,最直接的防控方法,就是用杀虫剂或者蚊帐来防蚊,有的地区也试图往开放的水源中“下毒”去杀死幼虫,疟疾的疫苗也顺利通过了临床实验。
有这么多的预防措施,联合着特效药青蒿素等,为什么疟疾死亡率还是这么高呢?仅在2018年,因疟疾死亡的病例就高达40万,儿童是主要的受害者。
《我不是药神》有一句话:“世界上只有一种病,那就是穷病”——这句话同样适用于疟疾。
疫苗是个好东西,但每针的价格高达13美元。经过计算,科学家发现,即使用最便宜的方法,保护两千六百万的儿童,大概需要花费国家总GDP的14%。何况疫苗不是打一次就行,而是需要持续数十年甚至更久,负担沉重。
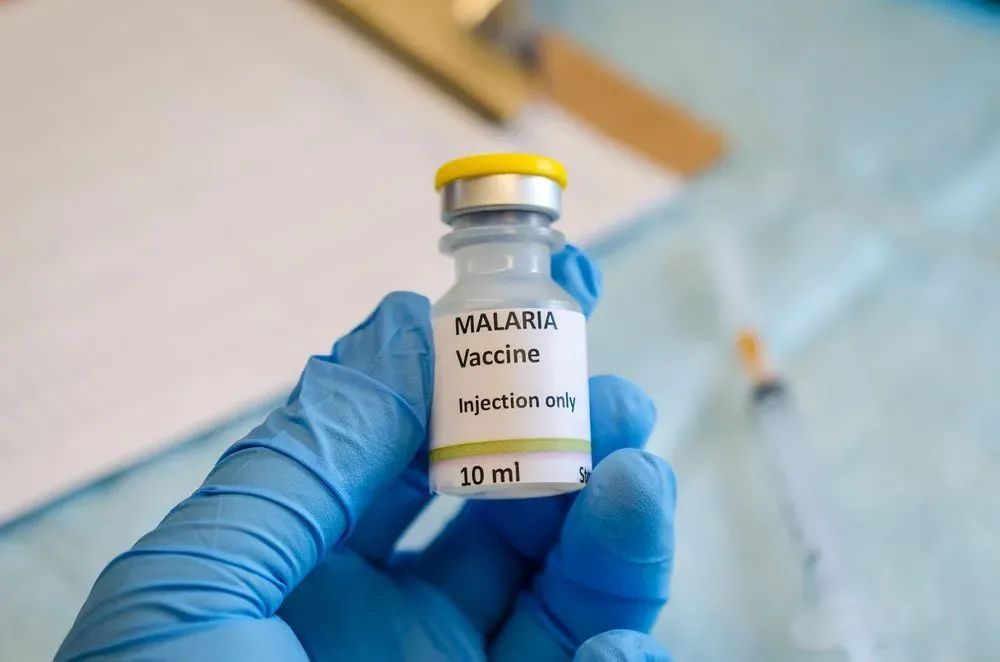
疫苗注射,在贫困地区难以推广 | homelandprepnews.com
于是,科学家们还在步履不停地研究其他的“新型武器”——例如,有名的基因驱动(Gene Drive)。
基因驱动的原理,是用基因改造技术做出一种很特别的基因:一般来说,一个基因被遗传到下一代的几率是50%,而这个特殊的基因则会有偏向性地遗传给下一代。科学家们找到了蚊子DNA中与繁衍或抵抗疟原虫相关的基因,将其进行改造,然后把改造过的蚊子放到野外。
这些蚊子,有的获得了对它们不利的基因,于是陆续死去,种群数量减少;要么获得了抵抗疟原虫的基因,使之不会被感染。

正常基因遗传(左)与基因驱动遗传(右)的种群对比 | Corporateeurope.org
在正常遗传情况下,随着蚊群的扩大,被改造的蚊子占比越来越少;而用了基因驱动之后,只要放出去一批疟蚊,被改造的基因就会慢慢扩散到整个蚊子族群,也不需要通过实验室手段来大量增加被改造过的蚊子。
这一控制疟蚊种群的方法,对饱受疟疾困扰的贫困地区来说,可谓是雪中送炭。即使负担不起疫苗,即使疟原虫产生了抗药性,只要将传播疾病的蚊子数量减下来,阻断传播途径,人们面临的感染风险也就大大减少。

而在此之前,药浸蚊帐必不可少 | WHO, Vlad Sokhin
当然,这种方法的问题也带来了科学层面的探讨。比如,修改一整个族群的基因,会不会给生态系统带来很大影响?这样做真的安全吗?我们怎么控制被基因改造的蚊子的分布?蚊子的消失会不会影响农作物产量等等。解答这些问题,还需要科学家们的更多努力。
相信科学的进步,定会助力于消灭这些疾病。许多的卫生组织、数不清的慈善机构,都尽力在帮这些贫困地区改善卫生条件,让更多的人喝到干净的水,得到充足的食物,温暖的住所,和先进的医疗与教育。各个国家也投资了大量的金钱来研究贫困地区的传染病,很多科研人员们更是把一生都奉献给了这项事业。
贫富差距还一直在,也许传染病还需要些时间才能从这个世界上消失,但人们守护同类、互相扶持的热忱,却从未消退过。

我们将继续守望相助 | worldvision.org
全球健康与发展守卫计划
我们关心科学家的每一次灵光一现,关心在未知领域的每一步开拓和探索。但这次,我们想把目光投向全球贫困人群。
他们生活窘迫,面对伤害也更加脆弱:气候变化、传染病、饥饿、贫困、新生儿死亡、性别歧视……科学和创新,能为他们带来什么?
由果壳发起的全球健康与发展守卫计划,通过招募并培养创作者、传播者,促进各类优质内容产生,鼓励传播和发声,从而将关注全球健康与全球发展的理念传播给大众,让贫困人群获得更多关注,并期待让这种关注实实在在改善他们的境遇。

编辑、排版:咻咻
题图来源:WHO, Vlad Sokhin
参考文献:
[1] Decerf B, Ferreira FH, Mahler DG, Sterck O. Lives and livelihoods: estimates of the global mortality and poverty effects of the Covid-19 pandemic. 2020.
[2] Wahid R, Cannon MJ, Chow M. Virus-specific CD4+ and CD8+ cytotoxic T-cell responses and long-term T-cell memory in individuals vaccinated against polio. Journal of virology. 2005; 79 (10): 5988-5995.
[3] Bhutta ZA, Sommerfeld J, Lassi ZS, Salam RA, Das JK. Global burden, distribution, and interventions for infectious diseases of poverty. Infectious diseases of poverty. 2014; 3 (1): 21.
[4] Eisenstein M. Poverty and pathogens. Nature. 2016; 531 S61-S63.
[5] Quick J, Loman NJ, Duraffour S, Simpson JT, Severi E, Cowley L, et al. Real-time, portable genome sequencing for Ebola surveillance. Nature. 2016; 530 (7589): 228-232.
[6] Wells CR, Pandey A, Parpia AS, Fitzpatrick MC, Meyers LA, Singer BH, et al. Ebola vaccination in the Democratic Republic of the Congo. Proceedings of the National Academy of Sciences. 2019; 116 (20): 10178-10183.
[7] Webster JP, Molyneux DH, Hotez PJ, Fenwick A. The contribution of mass drug administration to global health: past, present and future. Philosophical Transactions of the Royal Society B: Biological Sciences. 2014; 369 (1645): 20130434.
[8] Rénia L, Goh YS, Peng K, Mauduit M, Snounou G. Assessing Malaria Vaccine Efficacy. Towards Malaria Elimination: A Leap Forw; Manguin, S., Dev, V., Eds. 2018; 339-362.
[9] Munhenga G, Brooke BD, Chirwa TF, Hunt RH, Coetzee M, Govender D, et al. Evaluating the potential of the sterile insect technique for malaria control: relative fitness and mating compatibility between laboratory colonized and a wild population of Anopheles arabiensis from the Kruger National Park, South Africa. Parasites & Vectors. 2011; 4 (1): 1-11.
[10] Hammond A, Galizi R, Kyrou K, Simoni A, Siniscalchi C, Katsanos D, et al. A CRISPR-Cas9 gene drive system targeting female reproduction in the malaria mosquito vector Anopheles gambiae. Nature biotechnology. 2016; 34 (1): 78-83.
欢迎个人转发到朋友圈

本文版权属于“我是科学家”,未经授权不得转载。如需转载请联系iscientist@guokr.com

关注公众号:拾黑(shiheibook)了解更多
[广告]赞助链接:
四季很好,只要有你,文娱排行榜:https://www.yaopaiming.com/
让资讯触达的更精准有趣:https://www.0xu.cn/
 关注网络尖刀微信公众号
关注网络尖刀微信公众号随时掌握互联网精彩
- 1 奋力谱写西部大开发新篇章 4935585
- 2 人参泡酒15年后竟“复活” 4970704
- 3 00后女孩当穿版模特:几秒换一套 4873161
- 4 星火成炬|宇宙级别的浪漫 4790691
- 5 点读机女孩高君雨全网被禁 4691083
- 6 人民币对美元中间价报7.1048元 4525470
- 7 多所高校学生因悬挂床帘被实名通报 4499681
- 8 1.7厘米留置针滞留男童体内5年 4355993
- 9 学生跳楼并给教师留信?谣言 4209345
- 10 小S将陪大女儿赴美留学 4105902







 果壳
果壳







