pixabay.com
- 导 读 -
最近,多家媒体报道俄罗斯学者们在一位免疫力低下的女子体内发现了18种变异新冠病毒。实际上,这位女子体内的新冠病毒并非有18种,而是指2020年8月20日从该女子体内分离得到的新冠病毒与4个月前感染她的新冠病毒相比,有18处不同。
那么,为何这一发现值得关注?这些变异是如何发生的?会有怎样的影响?本文将尝试进行分析解读。
● ● ●
新冠肺炎的轻症患者大部分可以在两周内痊愈,而重症患者则可能携带新冠病毒长达六周甚至更久。近期,来自俄罗斯莫斯科斯科尔科沃科技学院的研究团队报道了一个携带新冠病毒长达四五个月之久的俄罗斯患者病例。该久病不愈的新冠肺炎患者为病毒的基因组演化提供了什么样的独特环境?与人类宿主长期共存的病毒会产生哪些变异?这些变异会对病毒产生什么样的影响?本文将尝试回答这些问题。
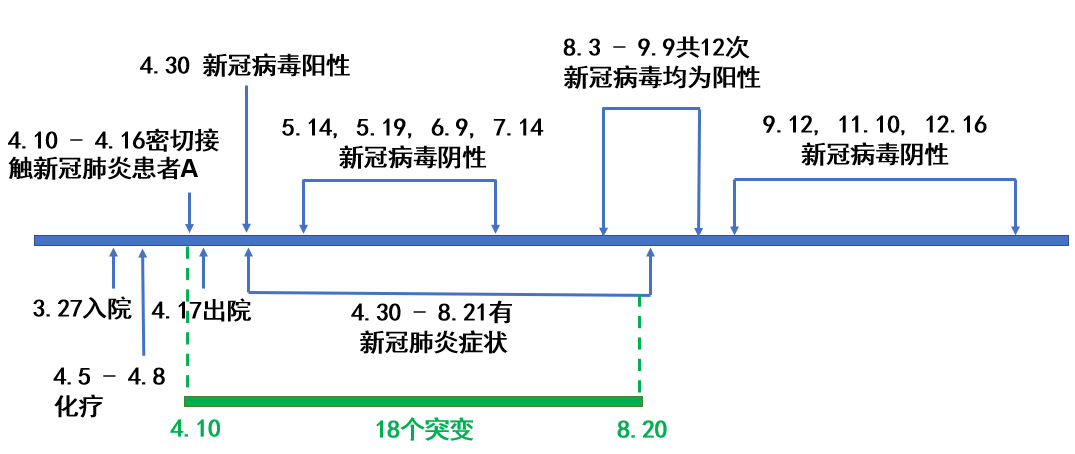
久病不愈的新冠肺炎患者S
俄罗斯患者S,女,47岁,患有B细胞淋巴瘤,免疫力低。2020年4月,患者S疑因在接受化疗住院期间与新冠肺炎患者A有密切接触,感染了新冠病毒。患者S的新冠肺炎症状持续至8月下旬,核酸阳性持续到9月上旬,携带病毒4个月有余 [1]。
俄罗斯莫斯科斯科尔科沃科技学院的研究人员对8月20日从患者S体内分离得到的新冠病毒进行了全基因组测序和分析,发现这株病毒与4个月前引发感染的新冠病毒基因组序列有18处不同。即,在这四个月内新冠病毒在患者S体内产生了18个变异。
新冠病毒在人际传播时平均一个月产生约2个变异 [2]。按照这个速率计算,4个月大约应该对应8个变异。换言之,新冠病毒在患者S体内的变异积累速率相较于人际传播提高了一倍还多,新冠病毒的基因组序列在患者S体内经历了快速的演化。
更为意外的是,从患者S体内分离出的新冠病毒携带了丹麦水貂疫情的特有变异:刺突蛋白Δ69-70HV和Y453F的连锁变异。Δ69-70HV是发生在刺突蛋白第69位和第70位的双氨基酸(组氨酸与缬氨酸,分别由H和V代表)缺失变异。而Y453F是刺突蛋白第453位的酪氨酸(Y)被苯丙氨酸(F)所替换的变异。因为不带有丹麦水貂新冠病毒的其他特征变异,所以俄罗斯学者推测患者S所携带的Δ69-70HV和Y453F变异与丹麦水貂不存在基因关联性,是在其体内独立演化产生的 [1]。
为什么在患者S体内会独立产生刺突蛋白的Δ69-70HV和Y453F的连锁变异?病毒在患者S体内还产生了什么其他变异?为什么在患者S体内新冠病毒会快速演化?
新变异能帮助病毒逃避免疫识别
病毒的刺突蛋白能识别细胞受体,对于新冠病毒感染及进入细胞至关重要。刺突蛋白的Δ69-70HV变异最早于2020年1月在泰国被报道,随后在其他国家和地区也陆续发现了独立产生的Δ69-70HV毒株 [3, 4]。而且自2020年8月以来,含有Δ69-70HV的新毒株在欧洲部分地区(特别是英国)频率迅速升高并持续扩散,引起了人们的广泛关注。Δ69-70HV还曾在水貂中被发现。丹麦水貂养殖场新冠疫情的调查研究显示,新冠病毒可能存在人-水貂互相传染的现象 [5],引起了全球的关注。从水貂中分离出的新冠病毒具有5个变异,其中就有刺突蛋白的Δ69-70HV变异。与人际传播时带有Δ69-70HV变异的病毒株不同,来自水貂体内新冠病毒的Δ69-70HV变异具有与Y453F变异连锁的特征 [3]。研究表明,刺突蛋白的Δ69-70HV和Y453F两个连锁的变异可能会促进病毒的迅速扩繁,而且能使病毒逃避中和抗体的免疫反应 [6]。为了避免新冠病毒在水貂中演化后再传染给人类,数百万只在丹麦养殖的水貂遭捕杀 [7]。俄罗斯学者这一报道的引人注目之处就在于,他们发现新冠病毒在患者S体内演化出了Δ69-70HV和Y453F两个连锁的变异。而且对其进行的基因组测序和分析显示,这两个连锁变异的产生与水貂无关 [1]。这可能是因为患者S免疫力相对低下,病毒在其体内存在较长的时间,为病毒适应人类宿主免疫系统的演化提供了更为充裕的时间。这意味着即使大规模捕杀携带新冠病毒的水貂,Δ69-70HV和Y453F的连锁变异依然可能威胁人类。 新变异能减轻感染者的临床症状
新冠病毒在患者S体内的长期存在,除了可以产生能帮助病毒逃避免疫系统的变异外,还可以产生可能会降低临床症状的变异,例如ORF8基因的Q18stop变异(蛋白在第18位的谷氨酰胺处终止,导致功能缺失)。早在2020年1月新加坡的一组病例中,就发现了一株ORF8功能缺失的毒株 [8]。临床数据显示,ORF8缺失突变毒株的感染者临床症状更轻,疾病预后更好。患者S体内分离的新冠病毒的ORF8基因丧失了功能,因此该变异可能会降低该新冠病毒患者的临床症状,与人类宿主长期共存而并没有导致宿主死亡。为何新冠病毒会在患者S体内快速积累变异?
首先,病毒序列的变异无时无刻不在发生。新冠病毒进入细胞后,遗传物质会进行成千上万次的复制。这个复制过程并不精确,常常引起变异。而新冠病毒在体内存在的时间越长,产生的变异就会越多。其次,如果病毒在患者体内产生的变异能够帮助病毒更好地感染细胞,增强病毒的复制能力,或者可以造成免疫逃逸,这些变异就会以更快的速度在病毒基因组上积累。区别于新冠病毒在人际传播过程,新冠病毒与特定人类宿主的长期共存为这类变异在病毒基因组上的积累提供了条件。第三,在免疫力低下的患者体内的新冠病毒受到的来源于人类宿主免疫系统的自然选择压力更小。可能是出于这个原因,一些使新冠病毒更加温和、患者临床症状减弱的变异也有可能在演化中保留下来,进一步增加了变异的积累速率。最后,患者S在感染新冠病毒时,刚刚做完化疗。有研究报道,化疗可能会增加突变率 [9]。因此,化疗也可能是导致患者S体内新冠病毒基因组变异加速的部分原因。久病不愈患者携带的病毒需引起重视
无独有偶,发表于2020年12月《新英格兰医学杂志》(The New England Journal of Medicine)的研究发现,新型冠状病毒在免疫能力低下的45岁男性患者体内也经历了快速的演化 [10]。另外,研究人员在其他两个免疫能力低下的患者的体内,包括上述45岁男性患者,也发现了独立产生的Δ69-70HV变异 [10, 11]。这些研究工作共同显示了在免疫低下的患者中新型冠状病毒可能存在独特的变异积累过程。在免疫功能低下的新冠肺炎患者体内的病毒长期演化的现象应当引起更多的重视。这些患者携带新冠病毒的时间更长,病毒基因组变异积累的时间也就更长。在这个过程中,病毒既可能获得提高其免疫逃避能力的变异,增大疫苗研发的难度,还可能获得毒性减弱的变异,为新冠肺炎的诊断和隔离防疫提出了新的挑战。
 参考资料:(可上下滑动浏览)
参考资料:(可上下滑动浏览)
1. GA, B., et al. Emergence of Y453F and Δ69-70HV mutations in a lymphoma patient with long-term COVID-19. 2021; Available from: https://virological.org/t/emergence-of-y453f-and-69-70hv-mutations-in-a-lymphoma-patient-with-long-term-covid-19/580.2. Hadfield, J., et al. Nextstrain: real-time tracking of pathogen evolution. Bioinformatics 2018; 34: 4121-3.3. Kemp, S., et al. Recurrent emergence and transmission of a SARS-CoV-2 Spike deletion H69/V70. bioRxiv, 2021: p. 2020.12.14.422555.4. Kemp, S., et al. Neutralising antibodies in Spike mediated SARS-CoV-2 adaptation. medRxiv, 2020: p. 2020.12.05.20241927.5. Oude Munnink, B.B., et al. Jumping back and forth: anthropozoonotic and zoonotic transmission of SARS-CoV-2 on mink farms. bioRxiv, 2020: p. 2020.09.01.277152.6. Lassaunière, R., et al. Working paper on SARS-CoV-2 spike mutations arising in Danish mink, their spread to humans and neutralization data. 2020; Available from: https://files.ssi.dk/Mink-cluster-5-short-report_AFO2.7. Denmark to cull 15 million mink after coronavirus spillover into humans. 2020; Available from: https://www.nationalgeographic.com/animals/2020/11/denmark-mink-culling/.8. Young, B.E., et al. Effects of a major deletion in the SARS-CoV-2 genome on the severity of infection and the inflammatory response: an observational cohort study. Lancet, 2020. 396(10251): p. 603-611.9. Kubota, M., et al. Cancer chemotherapy and somatic cell mutation. Mutat Res, 2000. 470(2): p. 93-102.10. Choi, B., et al. Persistence and Evolution of SARS-CoV-2 in an Immunocompromised Host. N Engl J Med, 2020. 383(23): p. 2291-2293.11. Avanzato, V.A., et al. Case Study: Prolonged Infectious SARS-CoV-2 Shedding from an Asymptomatic Immunocompromised Individual with Cancer. Cell, 2020. 183(7): p. 1901-1912 e9.
知识分子由非营利公益组织北京市海淀区智识前沿科技促进中心主办,以传播科学知识、弘扬科学精神、促进科学文化为使命,致力于关注科学、人文、思想。本文经授权转载自知识分子(ID:The-Intellectual),如需二次转载请联系原作者。
关注公众号:拾黑(shiheibook)了解更多
[广告]赞助链接:
四季很好,只要有你,文娱排行榜:https://www.yaopaiming.com/
让资讯触达的更精准有趣:https://www.0xu.cn/


 参考资料:(可上下滑动浏览)
参考资料:(可上下滑动浏览)
 关注网络尖刀微信公众号
关注网络尖刀微信公众号






 果壳
果壳







