AI可以改写人类基因组吗?首次由AI从头设计的基因编辑器成功编辑人类细胞中DNA
将 ScienceAI 设为星标
第一时间掌握
新鲜的 AI for Science 资讯


编辑 | 凯霞
生成式 AI 可以对话、写诗、画图、做视频、作曲、写代码......
那么,AI 可以改写人类基因组吗?
现在,新的 AI 技术正在为可编辑 DNA 的微观生物机制绘制蓝图,这预示着未来科学家将以更高的精度和速度对抗疾病。
近日,美国 AI 蛋白质设计初创公司 Profluence 推出了 OpenCRISPRTM 计划,发布了世界上第一个开源的 AI 生成的基因编辑器。
Profluence 展示了通过 AI 从头开始设计的可定制基因编辑器,对人类基因组的首次成功精确编辑。
该技术基于驱动 ChatGPT 的相同方法。正如 ChatGPT 通过分析维基百科文章、书籍和聊天记录来学习生成语言一样,Profluent 的技术在分析大量生物数据,包括科学家已经用来编辑人类 DNA 的微观机制,然后创建了新的基因编辑器。
相关研究以「Design of highly functional genome editors by modeling the universe of CRISPR-Cas sequences」为题,于 2024 年 4 月 22 日发布在预印平台 bioRxiv 上。

OpenCRISPR-1 是一款 AI 创建的基因编辑器,由类似 Cas9 的蛋白质和引导 RNA 组成,完全使用 Profluence 的大语言模型 (LLM) 开发。
通过 OpenCRISPR 的训练过程,该公司的 AI 从大规模序列和生物背景中学习,生成数百万种自然界中不存在的多种 CRISPR 类蛋白质,从而以指数方式扩展了几乎所有已知的 CRISPR 家族。

为了实现技术民主化,Profluence 推出了 OpenCRISPR-1 作为初始开源版本,使 AI 设计的基因编辑器可以免费获得伦理研究和商业用途的许可。
Profluence 联合创始人兼首席执行官 Ali Madani 表示:
「尝试用 AI 设计的生物系统编辑人类 DNA 是一项科学登月计划。我们的成功预示着未来,AI 可以精确设计所需的内容,来创造一系列定制的疾病疗法。为了刺激基因编辑领域的创新和民主化,以推动未来向前发展,我们正在开源该计划的产品。」
探索全部蛋白序列变异,AI 只需几小时
到目前为止,蛋白质工程界通常依靠基于发现的方法来从自然界复制功能性蛋白质,或通过称为定向进化的过程进行迭代修改。许多转化蛋白都是偶然发现的。
CRISPR-Cas9 基因编辑系统的核心组成部分是 Cas9 蛋白,它是一种 RNA 引导的核酸酶,可以搜索人类基因组中的全部 30 亿个核苷酸,并仅在一个特定位点进行切割。
这种核酸酶与单向导 RNA(sgRNA)结合在一起,sgRNA 由一个支架组成,它在结构上与蛋白质相互作用,间隔序列可以被编程为靶向基因组中的任何位置。

鉴于大多数 Cas9 蛋白的长度超过 1000 个氨基酸,总体设计空间包含 20^1000 个可能的序列,这比可观测宇宙中的原子数量多几个数量级。然而,由于这些蛋白质必须以精确的顺序协调许多相互作用才能实现精确切割,因此即使是单个错误的突变也可以完全破坏蛋白质功能。
通过实验探索所有可能的序列变异需要很多很多的时间,但在几个小时内,AI 系统就可以在这个搜索空间中导航从而发现功能性基因编辑器。
语言模型生成多种 CRISPR-Cas 蛋白
生成蛋白质语言模型通常是在涵盖广泛功能的大型、多样化的天然蛋白质序列数据集上进行预训练的。它们可以生成反映天然蛋白质特性的真实蛋白质序列。然而,对于特定的应用,例如新型基因编辑器的生成,我们需要引导生成特定的感兴趣的蛋白质家族。
为此,Profluence 的研究团队进行了详尽的数据挖掘,来构建迄今为止最广泛的 CRISPR 系统数据集。将此资源称为 CRISPR-Cas Atlas。
总而言之,研究发现了 510 万个 CRISPR-Cas 蛋白,将这些系统的已知自然多样性总体扩展了 2.7 倍,特别是 Cas9 扩展了 4.1 倍。
为了生成新型 CRISPR-Cas 蛋白质,研究人员在 CRISPR-Cas Atlas 上训练了蛋白质语言模型。从这个模型中生成了 400 万个序列,并使用生物信息学技术去除简并序列并鉴定每个生成的蛋白质属于哪个 CRISPR-Cas 家族。与 CRISPR-Cas Atlas 中发现的天然蛋白质相比,这组过滤后的生成序列的多样性扩大了 4.8 倍。

生成的基因编辑器在人类细胞中发挥作用
研究人员进一步将注意力集中在 CRISPR-Cas9 系统上,并根据 CRISPR-Cas 图谱中的 238,917 个 Cas9 蛋白训练了蛋白质语言模型。
鉴于 SpCas9 的广泛采用和临床成功,使用模型来生成可与 SpCas9 互操作的 Cas9 类蛋白。换句话说,它们结合基因组的相同部分(PAM)并与相同的 sgRNA 兼容;因此,它们可用于相同的应用程序。
然后,从这些生成的序列中选择了 48 个,用于对人类细胞进行严格的功能表征。OpenCRISPR-1 在靶标位点上的活性与 SpCas9 相当(OpenCRISPR-1 的编辑为 55.7%,SpCas9 的编辑为 48.3%),但令人惊讶的是,脱靶位点的编辑减少了 95%(OpenCRISPR-1 的编辑率为 0.32%,而 SpCas9 的编辑率为 6.1%)。
此外,OpenCRISPR-1 是一种高度新颖的蛋白质:它距离 SpCas9 有 403 个突变,距离 CRISPR-Cas 图谱中的任何天然蛋白质有 182 个突变。

接下来,研究证明,当与脱氨酶配对时,OpenCRISPR-1 和 SpCas9 在精确编辑靶标基因组中的单个碱基时具有相似的活性和特异性。此外,能够通过使用另一个经过 Profluence 训练的蛋白质语言模型生成的脱氨酶来保持碱基编辑活性,同时提高特异性。

最后,为了进一步优化生成的核酸酶的活性,研究人员还训练了一个模型来为任何给定的 Cas9 类蛋白生成兼容的 sgRNA。与 SpCas9 的 sgRNA 相比,这些生成的 sgRNA 可以提高所测试的 5 种蛋白质中的 4 种生成的核酸酶的活性。
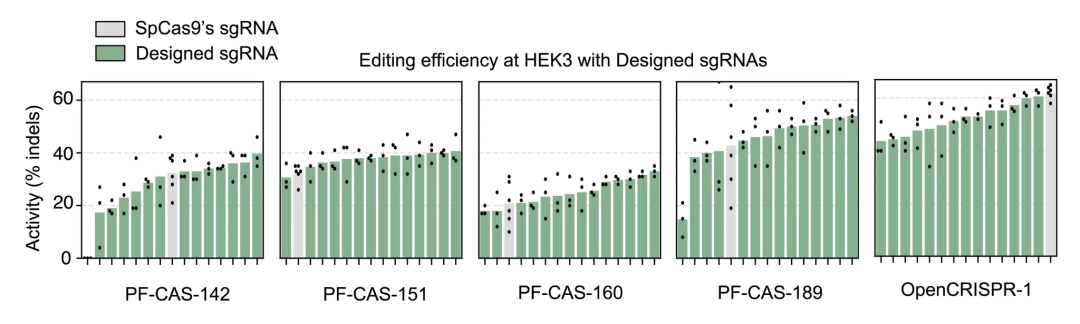
OpenCRISPR-1 只是冰山一角
研究展示了世界上首次使用基因编辑系统成功编辑人类基因组,其中每个组件都完全由 AI 设计。
此外,平台能够随意生成更多的基因编辑系统;OpenCRISPR-1 只是冰山一角。
团队公开发布了 OpenCRISPR-1,促进在研究和商业应用中广泛、合乎道德的使用。在向更广泛的社区提供这种分子的过程中,研究人员希望降低基于 CRISPR 的技术的治疗、农业和科学应用的成本和进入门槛。
Profluence 副总裁兼基因编辑主管 Peter Cameron 表示:「这是一个分水岭,也是我们希望在着手构建下一代基因药物时迭代过程的开始。我们鼓励基因编辑社区对 OpenCRISPR-1 进行压力测试。如果有可以针对特定应用进行改进的特定功能,我们想知道,并可以合作优化这些特性。」
人工智能 × [ 生物 神经科学 数学 物理 化学 材料 ]
「ScienceAI」关注人工智能与其他前沿技术及基础科学的交叉研究与融合发展。
欢迎关注标星,并点击右下角点赞和在看。
点击阅读原文,加入专业从业者社区,以获得更多交流合作机会及服务。
关注公众号:拾黑(shiheibook)了解更多
[广告]赞助链接:
四季很好,只要有你,文娱排行榜:https://www.yaopaiming.com/
让资讯触达的更精准有趣:https://www.0xu.cn/
 关注网络尖刀微信公众号
关注网络尖刀微信公众号随时掌握互联网精彩
- 1 《求是》发表习近平总书记重要文章 7904222
- 2 《怦然心动》导演家中死亡 其子已被捕 7809300
- 3 销售直言不建议买35万玛莎拉蒂 7713443
- 4 明年经济工作政策取向确立这八个字 7616838
- 5 香奈儿“购物篮”包拍出超百万天价 7522057
- 6 9天涨粉400万的“蛋神”发声 7425146
- 7 泰柬冲突急转直下 世界三个没想到 7330324
- 8 欧洲拟组“多国部队”支持乌克兰 7231389
- 9 金建希被曝曾深夜激烈怒斥尹锡悦 7143276
- 10 如何让你我的钱袋子鼓起来 7047720







 人工智能学家
人工智能学家







